Iso4, applicazione tecniche analitiche
Isotopi stabili di Ossigeno, Carbonio, Idrogeno ed Azoto

Utilizzo delle variazioni isotopiche naturali dell'azoto in campo agronomico ed idrogeologico
ISO4 ha una comprovata esperienza nella realizzazione di analisi isotopiche del nitrato (15N + 18O del NO-3). Studi sono stati condotti sia in campo agronomico, per la quantificazione dei processi di mineralizzazione ed assimilazione dei concimi da parte delle piante, sia in campo idrologico, per la definizione dei processi di riduzione dei nitrati nelle acque lacustri e l'individuazione delle contaminazioni in acque di falda utilizzate per scopi idropotabili.
Premessa
Da alcuni anni sono andati sviluppandosi gli studi sul ciclo dell'azoto nei suoli: l'argomento è di interesse per gli agronomi, che intendono ottimizzare la qualità la quantità dei concimi da apportare alle colture, ma è anche entrato di prepotenza ad interessare gli idrogeologi, che spesso trovano i nitrati al disopra dei limiti di potabilità delle acque di falda superficiale in zone intensamente coltivate.
L'azoto è un elemento biologicamente attivo e partecipa a molte reazioni importanti per la vita. La decomposizione della materia organica rilascia azoto organico, il quale si ossida a nitrato (NO-3), un contaminante comune nelle acque superficiali e sotterranee. A concentrazioni superiori ai 10 mg-N/l, il nitrato interferisce con la capacità dell'emoglobina di trasportare ossigeno nei neonati (metemoglobinemia). I nitrati possono anche essere implicati nella formazione di composti nitrosamminici, cancerogeni per l'essere umano. Lo ione ammonio (NH+4) è invece tossico per molte forme di vita acquatica.
La legislazione italiana, così come quella comunitaria, indica come valore guida per la concentrazione dei nitrati nelle acque ad uso idropotabile 5 mg/l, mentre la concentrazione massima ammissibile è di 50 mg/l (D.P.R. n. 236 del 24/05/1988). Inoltre, un recente decreto legislativo (D. Lgs. n. 152 del 11/05/99) fornisce indicazioni precise per il trattamento delle acque reflue urbane e la protezione delle acque dall'inquinamento provocato dai nitrati provenienti da fonti agricole. Quest'ultimo fissa a 25 mg/l il limite per la seconda classe di qualità dei corpi idrici sotterranei, ad impatto antropico ridotto e con buone caratteristiche idrochimiche.
Il ciclo naturale dell'Azoto
L'azoto viene incorporato nelle cellule delle forme viventi, anche le più semplici. La fissazione dell'azoto nei gruppi amminici biodisponibili (N2–› NH2), richiede energia per rompere il legame N-N dell'azoto atmosferico (N2). La fissazione dell'azoto è effettuata dalle alghe blu-verdi così come dai batteri azoto-fissatori presenti nelle radici delle leguminose. La maggior parte delle piante invece deriva l'azoto dall'ammonio presente nel suolo, a partire dal quale esse sintetizzano l'azoto organico.
Quando la materia organica muore, l'azoto organico viene ritrasformato in ione ammonio (NH+4), per essere riciclato: questa è la ragione per la quale compost e letame sono ottimi fertilizzanti. In condizioni aerobiche, parte dell'ammonio si ossida a nitrato secondo la reazione:
Nitrificazione NH+4 + 2O2–› NO-3 +2H+ + H2O
Il nitrato è la forma più labile dell'azoto, dopo il gas N2, nelle acque sotterranee. Concentrazioni minori della forma intermedia di nitrito (NO-2) possono anche essere presenti.
Poiché i sali nitrici sono altamente solubili, non esistono praticamente limiti alla presenza di nitrati in acqua. I processi di attenuazione della concentrazione in nitrati sono esclusivamente la diluizione e la denitrificazione. Quest'ultima è una reazione organica che avviene in assenza di ossigeno (condizioni anaerobiche) ed in presenza di un substrato organico, generalmente costituito da carbonio organico disciolto:
Denitrificazione NO-3 + 5/4 CH2O–› 1/2 N2 + 5/4 HCO-3 + 1/4 H+ + 1/2 H20
La denitrificazione avviene in genere ad opera di un batterio, il Thiobacillus denitrificans, anche se altri organismi possono operare la denitrificazione anche in assenza di carbonio organico.
Caratterizzazione isotopica delle potenziali fonti di nitrati in acqua
In un bacino o in una regione naturale, le fonti principali di nitrati sono:
- i nitrati sintetizzati nel suolo dai processi microbici di mineralizzazione (e nitrificazione) della materia organica dei suoli
- i nitrati provenienti dall'ossidazione della materia organica legata alle attività ntropiche, agricole (letame) o urbane (rifiuti domestici)
- i nitrati (più in generale l'azoto) di sintesi industriale (concimi)
Le variazioni isotopiche naturali dell'azoto (rapporto 15N/14N) si sono rivelate un utile strumento per distinguere le diverse fonti di nitrati (Fig.1). In particolare, i concimi industriali sintetizzano l'urea a partire dall'azoto atmosferico: questo processo è accompagnato da uno scarso frazionamento, e la loro composizione isotopica rimane prossima a quella atmosferica. Invece, la metabolizzazione dell'azoto attraverso la catena alimentare è accompagnata da un frazionamento sempre maggiore, proporzionale al livello trofico dell'organismo: ne risulta che i nitrati provenienti dall'ossidazione di materia organica prodotta da organismi superiori sono arricchiti in 15N fino a 20?. è dunque possibile, sulla base della composizione isotopica dei nitrati in soluzione, distinguere quelli in provenienza dai concimi sintetici, da quelli originati dalla materia organica naturale del suolo, da quelli ancora provenienti da concimi organici (letame), fosse settiche e reticoli fognarii perdenti.
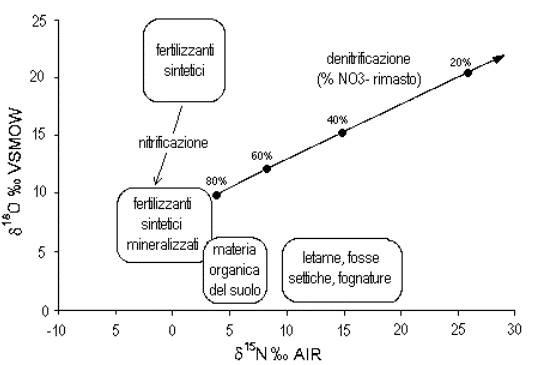
Figura 1 - individuazione delle diverse fonti dei nitrati in soluzione sulla base della loro composizione isotopica (modificato da Clark e Fritz, 1997)
Un'ulteriore possibilità offerta dagli isotopi è basata sull'utilizzo accoppiato dell'analisi isotopica dell'ossigeno della molecola del nitrato. Infatti, a causa della diversa origine dell'ossigeno incorporato nella molecola (in parte atmosferico, in parte proveniente dall'acqua), i nitrati originati dai concimi sintetici mostrano una composizione isotopica diversa rispetto a quelli provenienti da altre fonti.
Inoltre, gli isotopi dell'ossigeno si sono dimostrati ottimi traccianti del processo di denitrificazione, che avviene con un arricchimento costante del nitrato rimasto secondo lo schema reazionale di Rayleigh (Fig.1). è quindi possibile sfruttare questa informazione per la definizione del pennacchio di inquinante in provenienza da una sorgente puntuale, ed identificare i processi di attenuazione in corso, ovvero distinguere tra una semplice diluizione della contaminazione ed una più auspicabile riduzione per denitrificazione.